编者按:在全球糖尿病患者数量持续攀升的严峻形势下,糖尿病视网膜病变(DR)作为糖尿病最常见的微血管并发症之一,正给全球医疗体系带来巨大挑战。而人工智能(AI)技术为应对这一全球性健康危机提供了全新解决方案。近日,在奥兰多举办的第129届美国眼科学会年会(AAO 2025)上,维也纳医科大学发布了一系列相关研究成果。其中Andreas Pollreisz教授进行了题为“Comprehensive care in diabetic retinopathy using AI in advanced imaging”的主题分享,以期为与会同道拓展视野,了解AI技术全方位重塑DR的筛查、诊断与治疗管理模式的新进展。

全球糖尿病负担加剧,DR诊疗需求迫在眉睫
根据国际糖尿病联盟(IDF)发布的2025年全球糖尿病地图(第11版)数据,全球糖尿病患者规模将迎来显著增长。2024年全球糖尿病患者为5.887亿人,预计到2050年这一数字将飙升至8.525亿,增幅高达45%,新增患者达2.638亿。这一严峻的流行病学趋势,让DR的早期筛查和精准诊疗成为全球医疗领域的迫切需求。

AI技术的飞速发展为解决这一难题提供了可能。从20世纪50年代早期AI概念的提出,到机器学习的兴起,再到深度学习的突破性进展,AI技术在医疗领域的应用日益成熟。在DR诊疗领域,基于深度学习的计算机视觉技术实现了图像分析的重大突破,通过对彩色眼底照片的快速处理,AI算法能够精准检测不同阶段的DR。
AI赋能DR筛查与OCT分析,构建高效诊疗体系
当前,AI技术在DR诊疗中构建了从临床到云端的完整工作流程:医疗机构使用眼底相机拍摄视网膜眼底照片并上传至云端,AI模型首先判断图像是否可分级,对于不可分级的图像则要求重新拍摄或进行散瞳处理;对于可分级图像,AI模型将完成DR分类以及糖尿病黄斑水肿的有无判定。随后,临床医师接收AI生成的结果,为患者提供咨询服务并决定是否需要转诊。
多项前瞻性研究验证了AI算法在DR检测中的优异性能。2018年Abramoff团队研发的IDx-DR模型,在包含900名患者的数据集上,对需治疗的DR检测灵敏度达87.2%,特异性为90.7%。2021年Heydon团队的EyeArt模型在英国3个糖尿病眼筛查点的30405名患者中,检测灵敏度高达95.7%。2022年Ruamviboonsuk团队采用的谷歌AI模型,在泰国9家初级护理诊所的7940名患者中,实现了94.7%的灵敏度和91.4%的特异性。这些数据充分证明,AI技术在DR检测方面已具备与专业医师相当的能力。
在实际应用中,新加坡全国性临床AI软件推广项目成效显著。作为全球首个获监管批准的医疗设备级临床AI软件全国规模化应用案例,AI辅助的SELENA+系统对比2010年前纯人工筛查、2010-2020年远程眼科筛查,在检测灵敏度和特异性上表现出色,有效解决专业分级人员短缺及假阳性转诊导致的三级眼科护理成本过高问题。
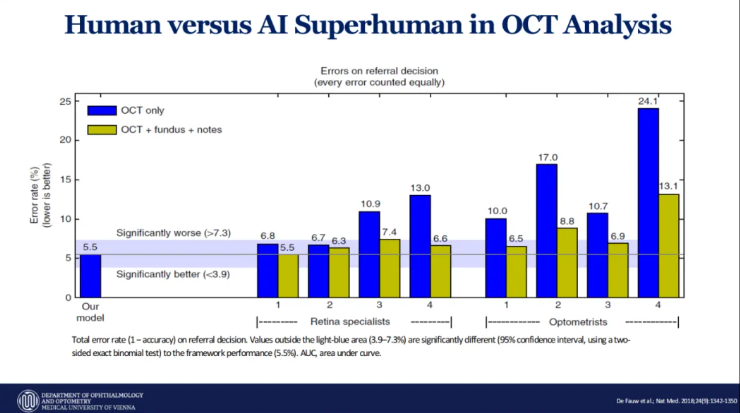
此外,AI技术在光学相干断层扫描(OCT)分析领域的应用同样成效显著。OCT生成的图像数据量巨大,其产生的扫描数据超过了其他所有医学成像方式的总和,对存储容量和解读专业知识都提出了极高要求,这也使其成为AI系统开发的理想场景。研究显示,AI辅助解读技术能够将专业医疗机构的诊断经验延伸至社区医疗机构,显著提升基层医疗的诊断水平。在转诊决策错误率对比中,维也纳医科大学研发的AI模型错误率仅为5.5%,不逊于视网膜专科医师和验光师。
AI推动DR诊疗精准化,多维度突破临床难题
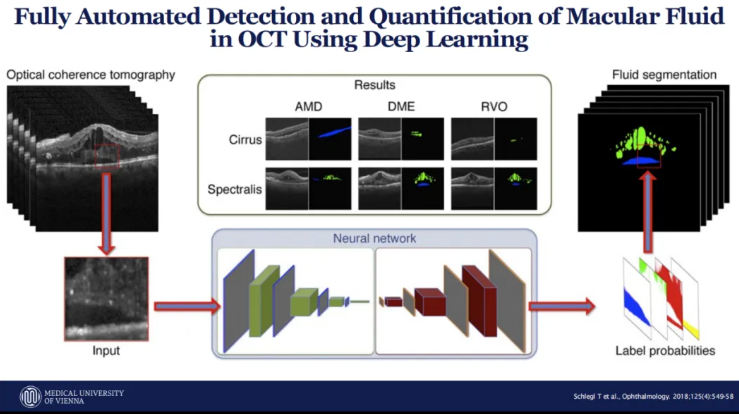
在糖尿病黄斑水肿的诊疗中,AI技术实现了黄斑液体积的全自动检测与定量分析。利用深度学习技术,可对年龄相关性黄斑变性、糖尿病黄斑水肿和视网膜静脉阻塞患者的OCT图像进行流体分割,精准识别视网膜内液和视网膜下液。研究发现,黄斑中心凹厚度(CST)作为传统的视觉功能评估指标,与视觉敏锐度的变化相关性较低,不能作为抗血管内皮生长因子(VEGF)治疗后视觉功能变化的替代指标。而AI技术量化的视网膜内液和视网膜下液体积变化,与视觉敏锐度变化呈现显著相关性,其中中心1mm区域的视网膜下液每减少10nL,视觉功能评分显著提升,这为治疗效果评估提供了更精准的依据。
AI技术还助力挖掘影响视觉功能预后的关键生物标志物。CHARTRES前瞻性观察研究显示,椭圆体带损伤程度和视网膜内层结构紊乱(DRIL)数值,是预测抗VEGF治疗糖尿病黄斑水肿患者视觉功能预后的有效指标。在67名研究对象中,良好应答者的椭圆体带损伤程度和DRIL数值显著低于中度应答者和不良应答者,相关差异具有统计学意义。
在DR进展监测方面,基于深度学习的广域OCTA分析技术展现出独特优势。新研发出的Q-NET质量评估模型和NPA-NET无灌注区评估模型,能够生成融合分割图谱,精准计算视网膜无灌注指数、黄斑无血管区面积等关键参数,为临床监测DR进展提供了客观依据。研究发现,DR分期越高,视网膜无灌注区域越广泛,基线视网膜无灌注程度越严重,病变进展风险越高。当无灌注缺血指数大于0.073时,患者更容易出现临床显著的糖尿病黄斑水肿,需要及时采取抗VEGF治疗或全视网膜光凝治疗。
AI技术还实现了对视网膜内微血管异常和新生血管的精准鉴别。通过OCTA技术的无创快速检测,AI算法能够识别突破内界膜的血流信号,有效区分两者。研究表明,不稳定的视网膜内微血管异常会使患者并发症风险增加3.88倍,这一发现对临床干预时机的选择具有重要指导意义。此外,基于深度神经网络的广域OCTA图像分析技术,通过视网膜色素上皮层分割实现视网膜扁平化处理、3D去噪以及内界膜自动分割,显著提升了糖尿病新生血管的检测精度。
基础模型与全球协作,AI引领DR诊疗未来
基础模型的发展为AI在DR领域的应用提供了新的可能。全球RETFound联盟通过整合海量未标记数据,训练出可适应多种下游任务的大型AI模型。该联盟采用合成眼底照片生成和模型权重安全共享的方式,在保护患者隐私的前提下,实现了全球患者数据的代表性覆盖。2024年启动的EviRed项目,构建了基于AI的DR新分类系统,通过纳入3000只眼的前瞻性队列研究,整合彩色眼底照片、OCT、OCTA以及临床数据等多模态信息,实现对DR并发症风险的精准诊断和评估,并为每位患者制定个性化随访和治疗调整方案。
维也纳医科大学的研究团队表示,AI正在彻底改变DR的诊疗模式,为患者全病程管理提供全方位支持。经过验证的AI筛查工具突破了专科诊所的地域限制,使精准检测触达更广泛的人群。深度学习技术在OCT和OCTA图像分析中的应用,实现了对流体、无灌注区和微血管变化的精准量化,为复杂影像数据解读注入客观性。未来,智能影像技术、全球数据协作与新一代OCT技术的深度融合,将推动糖尿病患者AI辅助临床护理模式的普及,为实现个性化的保眼治疗提供强大技术支撑。在全球糖尿病负担持续加重的背景下,AI技术与DR诊疗的深度融合,不仅有效提升了诊疗效率和精准度,更拓展了医疗服务的可及性。随着技术的不断迭代和临床应用的持续深化,AI有望成为应对DR这一全球性健康挑战的核心力量,为全球糖尿病患者带来视力保护的新希望。
参考来源:AAO官网
声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
2 comments






 京公网安备 11010502033360号
京公网安备 11010502033360号
条评论
Linda Gareth
2015年3月6日, 下午2:51Donec ipsum diam, pretium maecenas mollis dapibus risus. Nullam tindun pulvinar at interdum eget, suscipit eget felis. Pellentesque est faucibus tincidunt risus id interdum primis orci cubilla gravida.