编者按:衰老是一个生物学过程,其特征是随着时间的推移,细胞和组织的结构损伤和功能下降,最终导致机体死亡。研究发现,异常的线粒体动力学改变和ROS过度产生可致年龄相关性神经疾病和年龄相关性眼病。调查发现,2019年我国中度和重度视力损害的主要病因是未矫正屈光不正、白内障和黄斑变性;而致盲的主要原因是白内障、未矫正的屈光不正和青光眼;与2009年相比,白内障和黄斑变性患病率明显提高,而这两种疾病均与衰老有关。因此,探究衰老与视神经损伤的相关性具有重要意义。第22届中国眼底病论坛暨国际视网膜研讨会(Retina China 2021)上,来自哈尔滨医科大学附属第二医院的原慧萍教授为我们带来了衰老与视神经损伤相关的最新发现。

衰老与视神经损伤的相关性
已有研究观察年龄对黄斑内六层视网膜厚度的影响,结果发现GCL、IPL、INL厚度随年龄增长而明显变薄,与年龄相关性视网膜神经节细胞轴突丢失的组织病理学研究相一致。随着年龄增长,青光眼患者患病率及发病率均明显增高,年龄超过70岁者发病率增加更为明显。多项研究证实,衰老能够增加RGCs细胞对眼压变化的敏感性。且与RNFL相比,年龄与GCL厚度之间的关系更为密切,这可能表明GCL厚度更适用于观察青光眼的进展(见图1)。
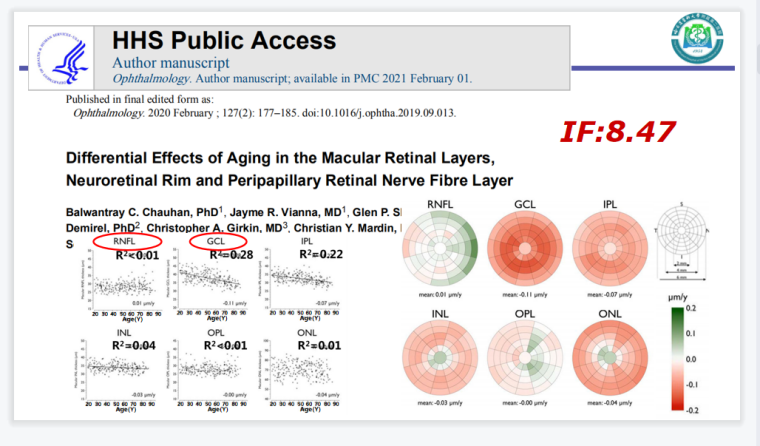
图1
衰老与诱发神经元损伤的相关性研究
哈尔滨医科大学附属第二医院原教授团队在2010年与美国加州大学和日本国立病院先后采用点突变建立了(OPTN E50K)突变的青光眼属模型基础上,2015年原教授团队又利用CRISPR/Cas9技术建立了(OPTN E50K)突变的青光眼动物模型。原教授表明,此研究在验证小鼠模型的基础上,通过DNA测序证实了E50K突变位点的存在。研究显示,各组之间眼压结果无明显差异。小鼠的视功能和形态学实验证实,视功能和视网膜厚度随着年龄增加而降低,并且E50K退行性改变更显著(见图2)。
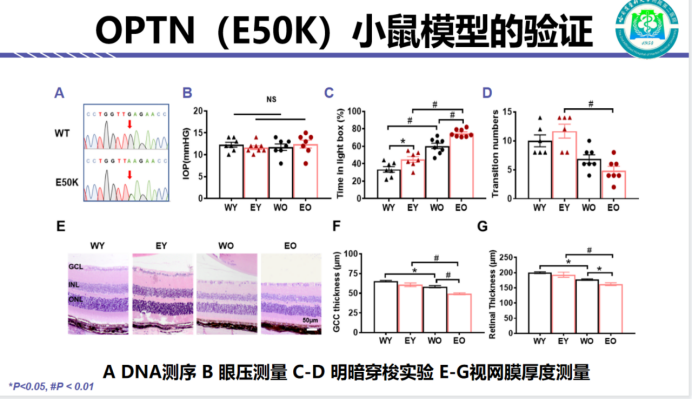
图2
研究还发现,衰老可降低视网膜厚度,OPTN(E50K)突变能够加速年老小鼠模型中视网膜变薄及RGCs凋亡,进而表现出青光眼表型;且OPTN(E50K)突变导致的RGCs丢失具有明显的年龄相关性(见图3)。
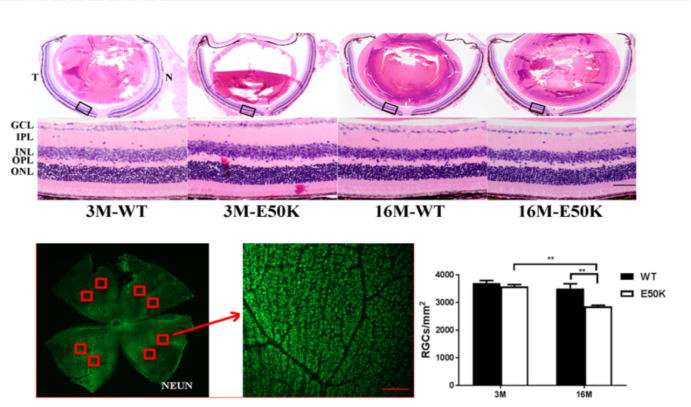
图3
NTG模型中衰老
诱发RGCs损伤的机制
原教授指出,目前已发现的衰老诱发RGCs损伤的机制主要分为以下几种:
1.衰老致线粒体功能障碍
线粒体对许多细胞功能至关重要。随着年龄增长,线粒体可表现为氧化磷酸化减少,DNA (mtDNA)突变积累、氧化DNA/脂质/蛋白损伤增加、结构紊乱和活性氧(ROS)增加。而神经视网膜和视网膜色素上皮细胞中的线粒体特别容易受到氧化损伤。越来越多的证据表明线粒体功能障碍在青光眼发病机制中发挥关键作用,且线粒体和编码线粒体蛋白的核基因突变导致的原发性视神经病变与青光眼性视神经病变十分相似。
除RGCs本身对线粒体功能障碍易感性之外,衰老线粒体的功能障碍对TM也具有重要影响。衰老相关的TM氧化损伤也与线粒体功能障碍、DNA和蛋白质组的改变有关。内皮功能障碍及其导致的内皮屏障功能受损,可使眼压增加并改变基因表达。在POAG和假性剥脱性青光眼(XFG)中,均观察到了线粒体损伤导致氧化损伤和继发的TM功能障碍。原教授团队在OPTN E50K鼠模型的研究中也发现,OPTN E50K+/+小鼠视网膜中线粒体复合物蛋白异常,视神经轴突线粒体形态异常,可致RGCs凋亡,且与年龄有关。
2.异常蛋白质聚集
异常蛋白质聚集是神经退行性病变的共性。与年龄相关的异常蛋白质聚集物,是细胞毒性的主要效应物。在青光眼动物模型发现,视网膜中异常蛋白积聚与RGCs的凋亡有关。原教授团队研究也发现,在NTG模型小鼠中观察到了自噬通量被抑制的现象,这些证实了异常蛋白质的聚集与自噬异常及NTG鼠的RGCs的凋亡有关(见图4)。
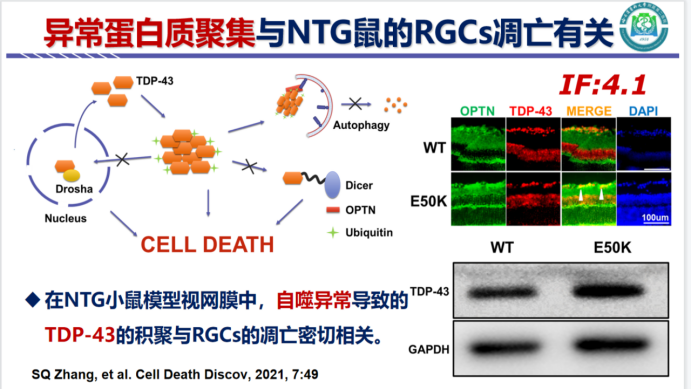
图4
3.组织结构改变
已有研究证实,年龄相关的眼组织硬化改变在相当数量的眼科病理中起着重要作用。ECM硬化可影响视神经对眼压的敏感度,是青光眼视神经损伤机制之一。青光眼患者的小梁网(TM)和视神经头(ONH)均发生病变广泛的ECM重构。慢性IOP升高导致胶原结构重构(红色),引起视神经损伤;IOP增加对视神经的影响受稳态基线结构和组织机械特性的影响(见图5)。
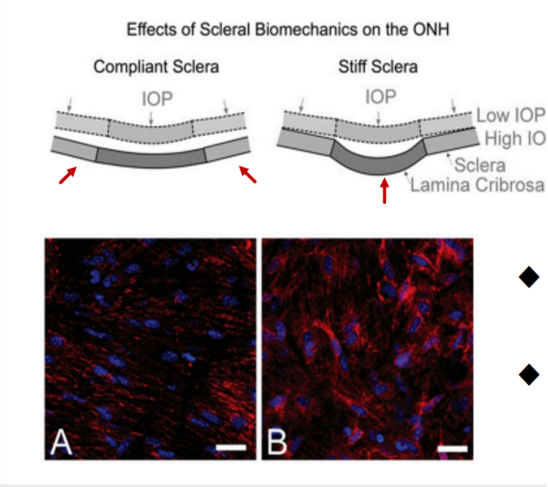
图5
4.其他相关机制
老年人常表现出较高的炎症介质水平,包括IL -6、CRP)、TNF-α等,这些促炎细胞因子都具有潜在的RGCs损伤性。原教授分析,自身免疫和神经炎症反应可能参与青光眼性视神经的损伤和RGCs的变性过程。IL-6含量升高会降低小梁网的吞噬功能和分泌功能,同时作用于T淋巴细胞和血管内皮细胞,导致血管内膜发生增殖性改变,这种变化能够与缺氧相互促进,加速缺氧对视神经的损伤。此外,原教授团队的研究还发现衰老可导致视网膜神经营养因子表达降低。
衰老细胞的年轻化
或可成为治疗新希望
有研究表明,当去除视网膜中具有衰老特征的细胞时,高眼压导致的RGCs凋亡明显减少。2020年哈佛大学医学院在Nature上发表了一篇有关重编程恢复年轻的表观遗传信息的相关文章。该研究利用基因治疗诱导神经节细胞重编程,恢复年轻的表观遗传信息,使得视神经能在损伤后再生,并逆转青光眼和衰老造成的视力下降。衰老的视神经节细胞在经过OSK基因治疗后,衰老相关基因的转录被恢复到年轻的水平。在青光眼的小鼠模型中,重编程基因治疗提高了青光眼模型鼠受损神经细胞的电信号水平和视动反应中的视力(见图6)。这一结果为广大患者带来新的希望。
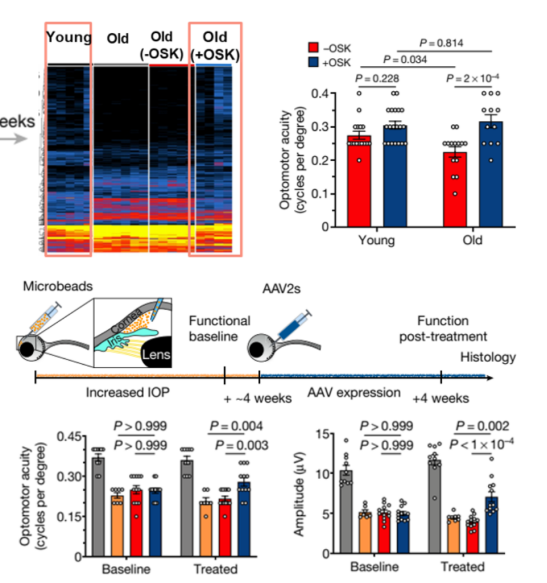
图6
小 结
衰老通过导致线粒体功能障碍和RGCs及TM细胞损伤、增加异常蛋白质聚集、引起RGCs退行性改变,并促进ECM重构和组织硬化增加RGCs损伤易感性,从而导致神经病变。相关研究为恢复衰老细胞年轻化的基因治疗使神经再生带来了很大可能性,同时也为视神经衰老损伤治疗提供了新希望,进一步坚定了研究信心,相信会为患者带来更多福音。
2 comments



 京公网安备 11010502033360号
京公网安备 11010502033360号
条评论
Linda Gareth
2015年3月6日, 下午2:51Donec ipsum diam, pretium maecenas mollis dapibus risus. Nullam tindun pulvinar at interdum eget, suscipit eget felis. Pellentesque est faucibus tincidunt risus id interdum primis orci cubilla gravida.