编者按:随着人们生活水平提升和饮食结构改变,糖尿病发病率大幅增加,其导致的眼部并发症也随之激增,糖尿病相关干眼便是其中之一。多数糖尿病患者只关注血糖控制,对糖尿病相关干眼等并发症并不重视,导致眼健康问题逐步加重,最终影响患者的生活质量。天津医科大学眼科医院赵少贞教授团队在糖尿病相关干眼领域深耕多年,开展多项研究深入探讨该病的发病机制,研究成果为广大眼科医师更好地治疗糖尿病相关干眼提供了重要参考依据。

专家简介
赵少贞 教授
主任医师,教授,博士生导师
●天津医科大学眼科医院副院长;
●中国医师协会眼科医师分会角膜病专业委员会委员;
●海峡两岸医药卫生交流协会眼科学专业委员会委员;
●中国医师协会医学科学普及分会眼科科普专业学组副主任委员;
●中国实验动物学会屏障医学专业委员会副主任委员;
●中国老年学和老年医学学会眼科学分会常委;
●亚洲干眼学会中国分会委员;
干眼是多因素引起的慢性眼表疾病,是由泪液的质、量及动力学异常导致的泪膜不稳定或眼表微环境失衡,可伴有眼表炎性反应、组织损伤及神经异常,造成眼部多种不适症状和(或)视功能障碍[1-5]。干眼是常见高发疾病,全球各地患病率差异较大。据统计,全球干眼平均患病率为22.8%,我国干眼患病率为21%~30%,干眼患者接近3亿[6-7]。
衰老是干眼最重要的因素之一,随着年龄增长,干眼的患病率逐渐增加。性别是干眼发生的另一重要因素,女性干眼患病率更高。此外,干眼还与视频终端、糖尿病、睡眠障碍、焦虑抑郁、脂代谢异常、隐形眼镜的使用、眼部手术等因素相关。
干眼流行病学调查研究
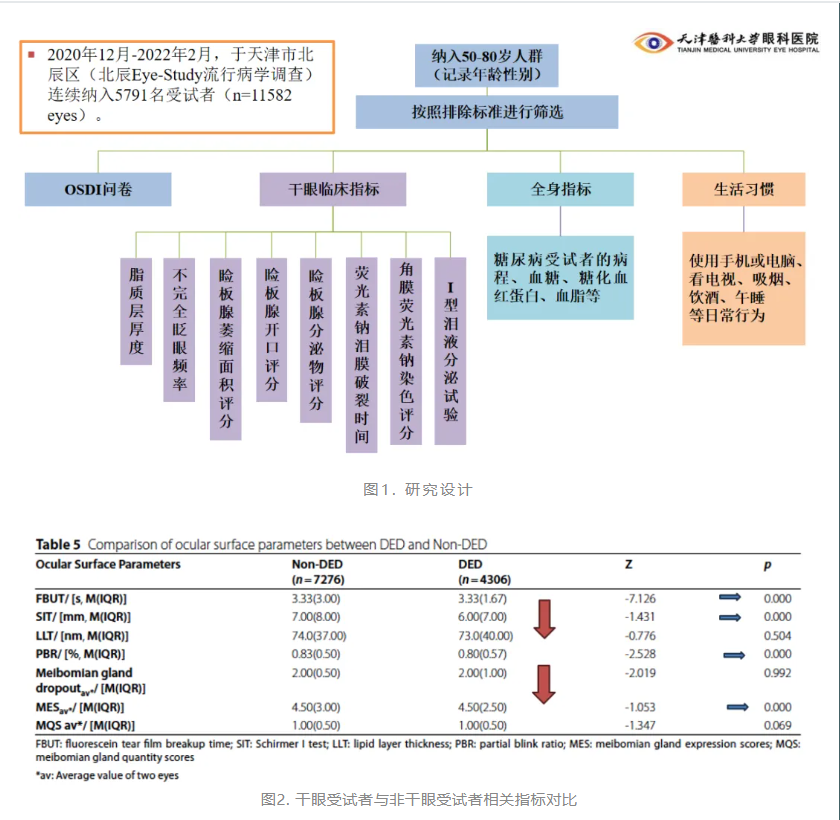
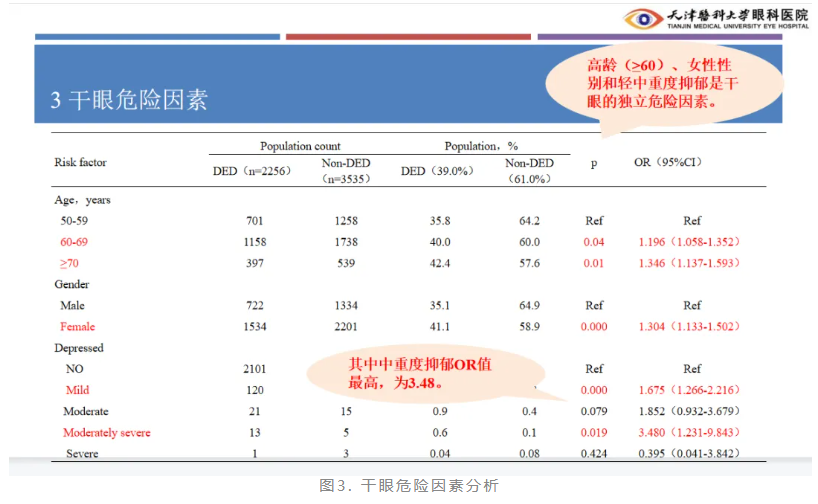
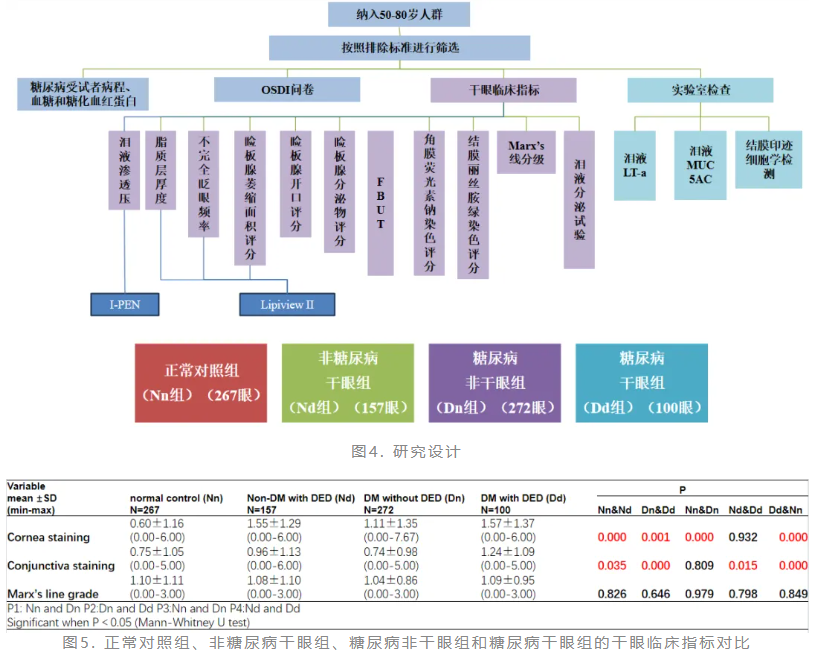
赵少贞教授团队曾进行一项基于人群的研究探讨50~80岁中老年人群干眼的特点。该研究在2020年12月~2022年2月,于天津市北辰区(北辰Eye-Study流行病学调查)连续纳入5791名受试者的11582只眼(图1)。结果显示,干眼患病率为39.0%,女性较男性干眼患病率显著增高。干眼受试者荧光素泪液破裂时间(FBUT)和Schirmer l试验、不完全眨眼比率(PBR)和睑板腺分泌物性状评分显著降低(图2)。干眼受试者的视觉能力严重受损,日常生活也因此受到影响。高龄(≥60)、女性性别和轻中重度抑郁是干眼的独立危险因素(图3)。
糖尿病相关干眼临床特点相关研究
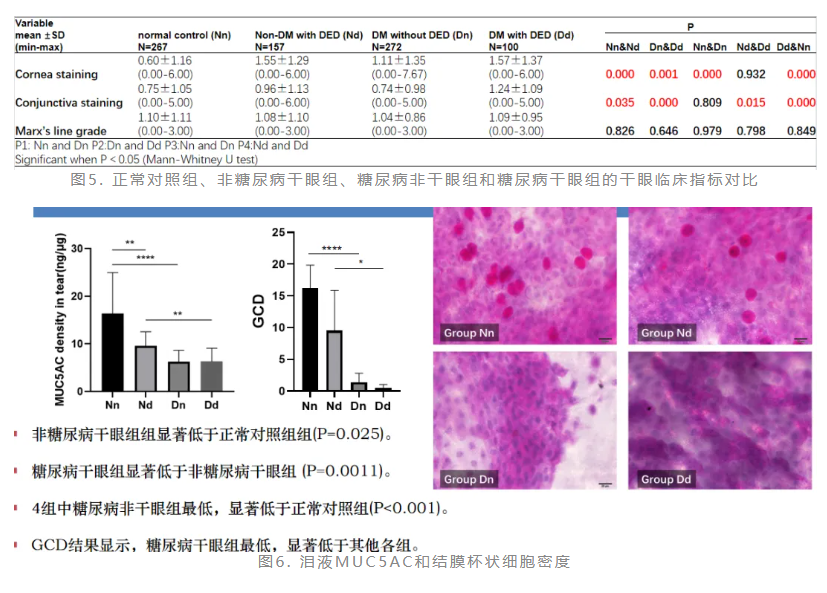
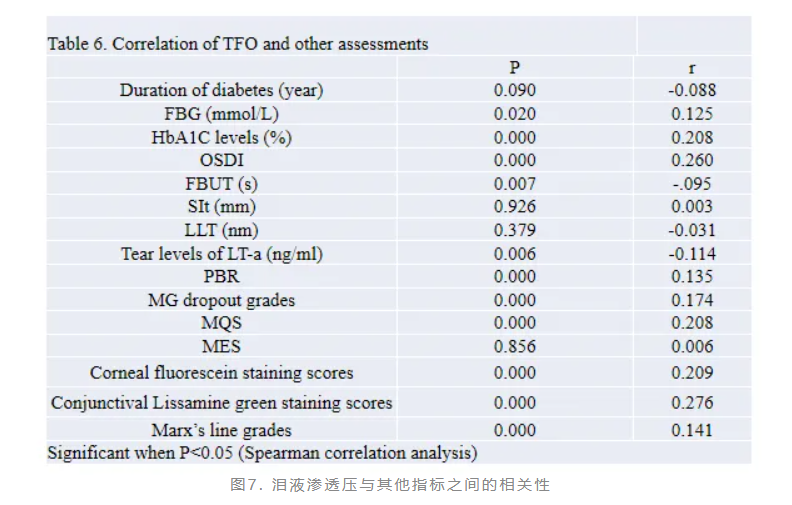
糖尿病相关干眼机制复杂、不明确影响因素多,血糖控制不佳者更易表现出眼表异常。赵少贞教授团队开展了探讨糖尿病相关干眼临床特点以及黏蛋白表达的研究(图4)。结果显示,糖尿病患者表现出更明显的干眼症状与体征分离。糖尿病相关干眼患者的角膜荧光素钠染色评分和结膜丽丝胺绿评分显著增高(图5),泪液中黏蛋白MUC5AC显著降低并伴随结膜杯状细胞减少(图6)。泪液渗透压与其他干眼临床指标具有较好的相关性(图7)。
糖尿病周围神经病变是糖尿病最常见的神经病变,占所有糖尿病神经病变的75%;高达70%的糖尿病患者在其疾病进程中遭受糖尿病性角膜神经病变的困扰[8]。研究显示,患有周围神经病变的糖尿病患者往往伴随角膜神经纤维长度及密度的减少,且糖尿病角膜神经病变的出现早于其他周围神经病变[9]。角膜神经作为泪腺功能单位(LFU)的传入神经,能够接收外界刺激,并通过传出通路(即来自脑桥上唾液腺核的副交感神经纤维及面神经)最终刺激泪腺、睑板腺和结膜杯状细胞分泌泪液,作用于眼表;其损伤影响LFU正常的信号传导及泪液的分泌,最终导致干眼的发生。
赵少贞教授团队多年来针对糖尿病相关干眼的神经损伤机制进行了诸多探索,包括体外实验和体内实验,为进一步研究糖尿病相关干眼的发生和防治提供了参考。
体外实验:4-HNE通过ERK通路损伤神经细胞的相关研究
4-羟基壬烯醛(4-HNE)是一种内源性脂质过氧化产物,可模拟糖尿病引起的氧化应激,在4-HNE刺激下,人角膜上皮细胞间紧密连接受损。而三叉神经节细胞上清液则可增强角膜上皮细胞的增殖、迁移能力。
突触小体相关蛋白(SNAP25)是神经特异性蛋白,在神经发育过程中参与树突和轴突的生长,SNAP25蛋白的表达对于轴突神经的生长和神经末梢的可塑性起到了关键作用。在末梢神经系统相关疾病,如原发性开角型青光眼视神经病变中,SNAP25表达量降低。多项研究通过增加SNAP25的表达量来治疗神经突触相关疾病[10-11]。
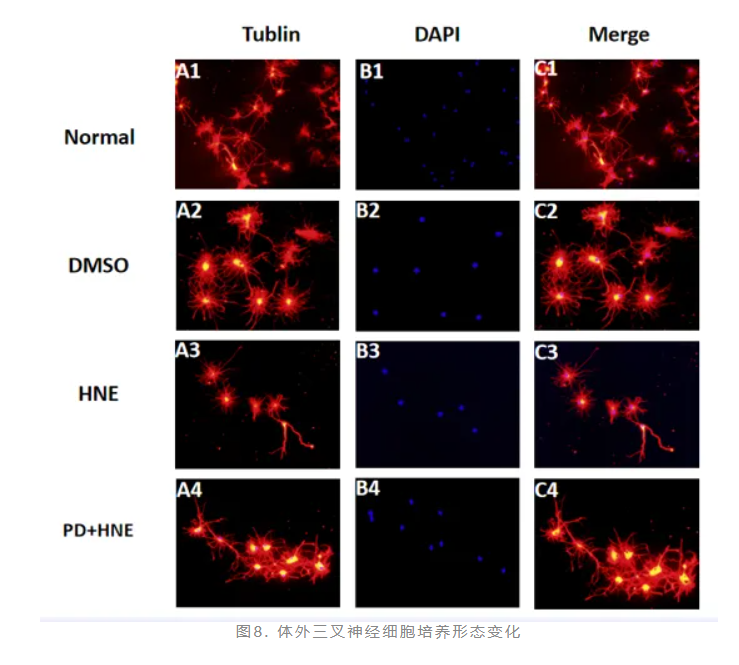
4-HNE通过激活ERK磷酸化抑制SNAP25的表达。体外三叉神经细胞培养可见,正常神经细胞形态良好,突触呈星芒状向外伸展;HNE刺激后神经细胞形态变差、细胞数量少,突触稀疏。PD组与正常组相比,形态无明显改变,突触长且密(图8)。
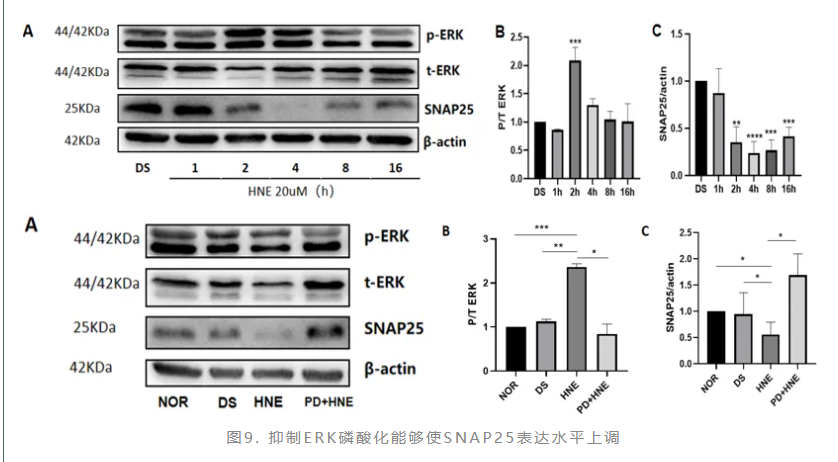
HNE刺激三叉神经细胞1~16小时后,ERK磷酸化水平一过性升高,SNAP25表达量减少,提示二者之间可能存在相关性。加入ERK抑制剂PD98059验证,结果显示抑制ERK磷酸化能够使SNAP25表达水平上调(图9)。
体内实验:糖尿病相关干眼小鼠模型眼表改变
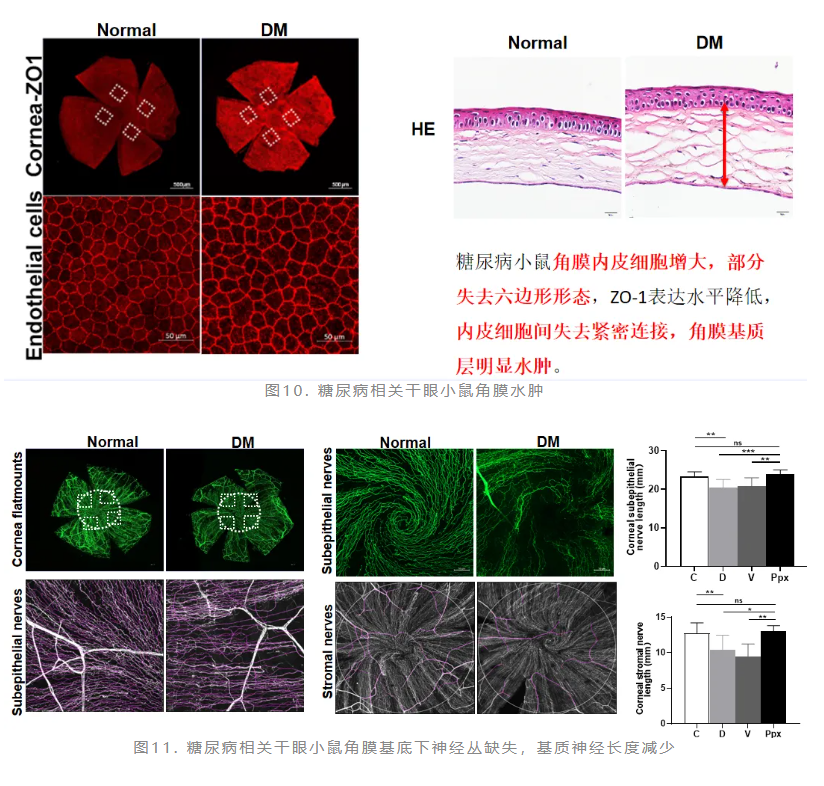
持续的高血糖可导致小鼠角膜知觉减退,泪液分泌减少,角膜上皮缺损。研究显示,糖尿病12周小鼠已出现糖尿病相关干眼。糖尿病相关干眼小鼠角膜水肿(图10),角膜基底下神经丛缺失,基质神经长度减少(图11),泪腺神经支配也出现异常(图12)。

体内实验:PEDF与糖尿病相关干眼的神经损伤相关性研究
色素上皮衍生因子(PEDF)是一种50kDa分泌蛋白,属于丝氨酸蛋白酶抑制剂家族成员,其分布广泛,在角膜上皮、视网膜及房水中均有分布。PEDF具有神经保护、抑制新生血管生成及抗氧化的作用,对于治疗氧化损伤导致的神经变性类疾病存在积极前景[12]。目前PEDF相关研究主要集中在眼底病变、阿尔兹海默症等疾病过程中,在糖尿病相关干眼领域的研究相对匮乏,对角膜神经的保护作用及机制尚不明确。
PEDF在正常小鼠三叉神经节、泪腺、睑板腺及角膜中均有表达,其在角膜中的含量稍低于其他组织。PEDF的mRNA水平在糖尿病相关干眼小鼠的角膜、泪腺及睑板腺中均显著下调(图13),提示内源性PEDF的缺失与糖尿病相关干眼的发生存在一定的相关性。

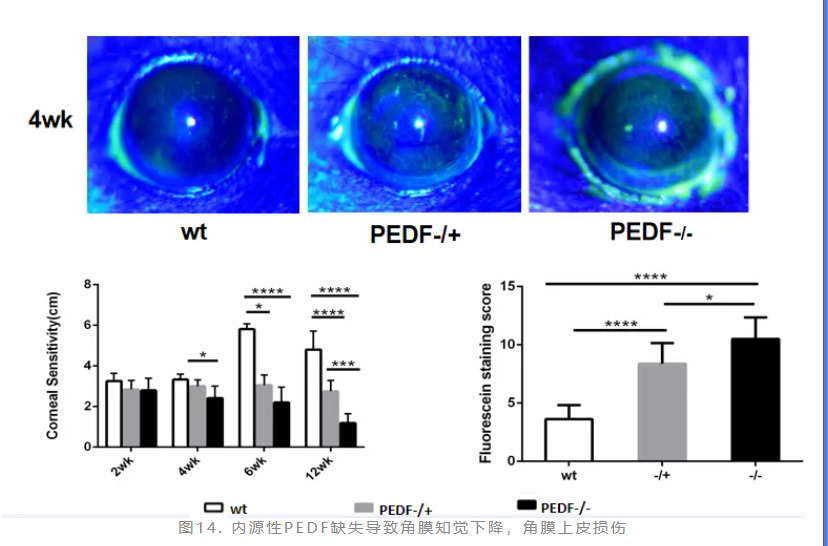
在出生后第4、6及12周,PEDF基因敲除鼠的角膜敏感度显著下降,内源性PEDF缺失破坏了角膜上皮的完整性(图14)。
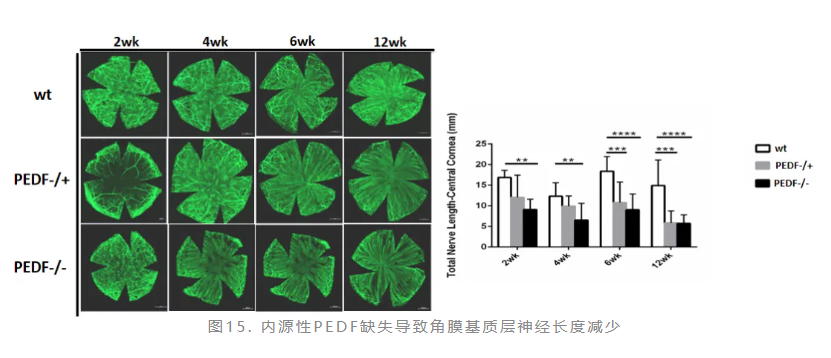
PEDF基因敲除小鼠角膜中央基质神经显著减少,在12周最为显著:相较于野生型,PEDF敲除鼠角膜神经减少62%(图15)。
神经营养因子在中枢和周边神经系统中调控神经元的存活和分化,从而促进神经的发育及再生,在许多神经疾病中具有积极的治疗意义。神经营养因子家族(NTFs)主要包括神经营养素家族和胶质细胞系衍生因子家族,前者包括神经生长因子(NGF)、脑源性神经因子(BDNF)、神经营养因子3(NTF-3)和NTF-4/5;后者包括胶质源性神经因子(GDNF)、ARTN、NRTN等。
PEDF可调控角膜及三叉神经节中神经营养因子的表达。研究显示,在基因敲除小鼠的三叉神经节中,神经营养因子的表达水平均下调,其中NGF及NT-3的变化最为显著;在基因敲除小鼠的角膜中,神经营养因子的表达水平均下调,其中NGF及BDNF的变化最为显著。PEDF可通过ERK及AKT途径发挥神经保护作用,PEDF的缺失降低三叉神经中ERK及Akt磷酸化水平,进而抑制角膜中ERK蛋白的磷酸化。
体内实验:PEDF及其相关肽改善糖尿病相关干眼神经损伤的机制研究
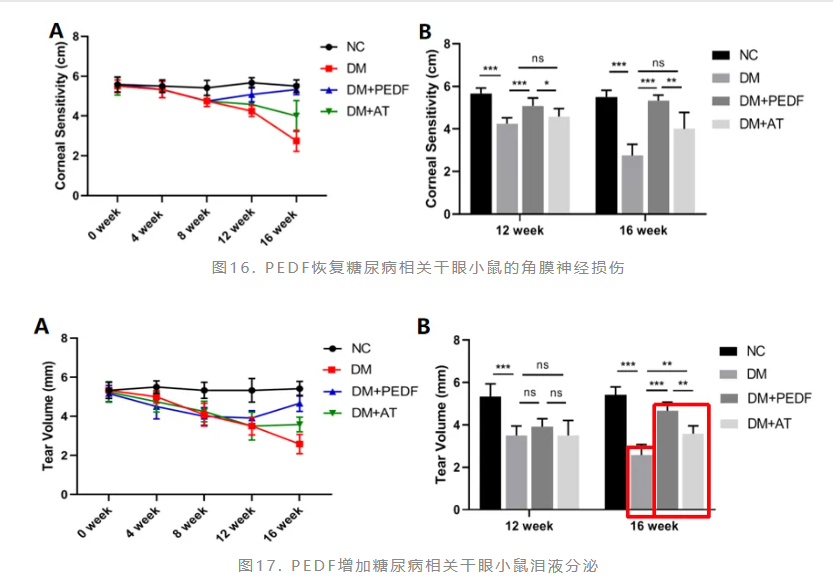
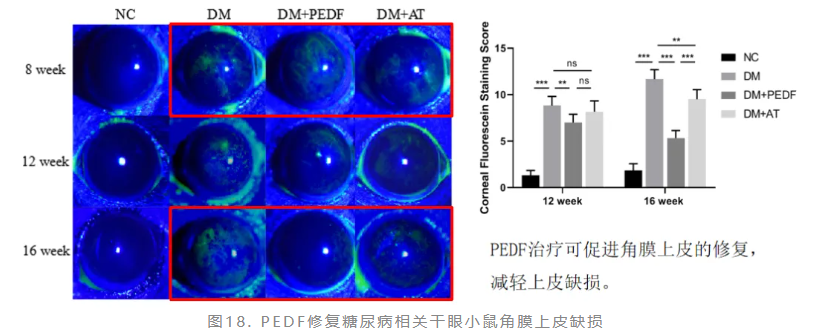
赵少贞教授团队观察了PEDF对糖尿病相关干眼小鼠的治疗作用,糖尿病造模8周后开始治疗,应用PEDF 50nM tid、人工泪液(AT)tid对小鼠进行眼药水点眼治疗。研究显示,PEDF局部治疗4周后,糖尿病小鼠的角膜知觉明显恢复;治疗8周后,糖尿病小鼠的角膜知觉恢复至正常水平,提示糖尿病小鼠的角膜神经损伤有所恢复(图16)。PEDF局部治疗8周后,糖尿病小鼠的泪液分泌量明显恢复,且效果显著优于单纯AT治疗组(图17)。此外,PEDF治疗可促进角膜上皮修复,减轻上皮缺损(图18)。
体内实验:SNAP25与糖尿病相关干眼的神经损伤相关性研究
研究表明,Snap25的蛋白水平在糖尿病相关干眼大鼠的角膜中显著下调,提示内源性Snap25的缺失与糖尿病相关干眼的发生存在一定的相关性,这与体外实验结果一致。
鉴于此,赵少贞教授团队开展研究探讨了Snap25对糖尿病相关干眼大鼠的治疗作用,在大鼠糖尿病6周时,结膜下注射携带SANP25慢病毒表达质粒。结果显示,SNAP25治疗后糖尿病相关干眼大鼠角膜知觉有所恢复,泪液分泌量增多;角膜基底膜下神经丛密度增加。SNAP25对糖尿病相关干眼具有积极的治疗作用(图19)。
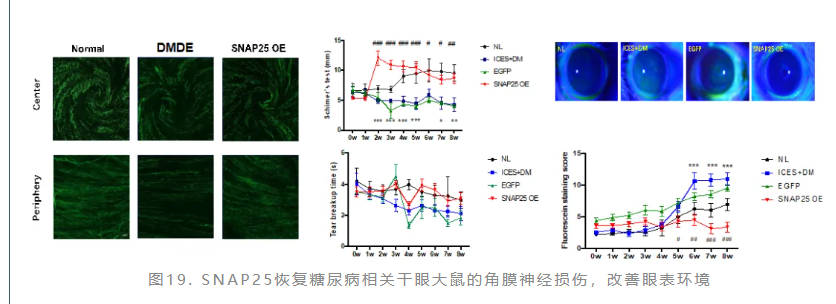
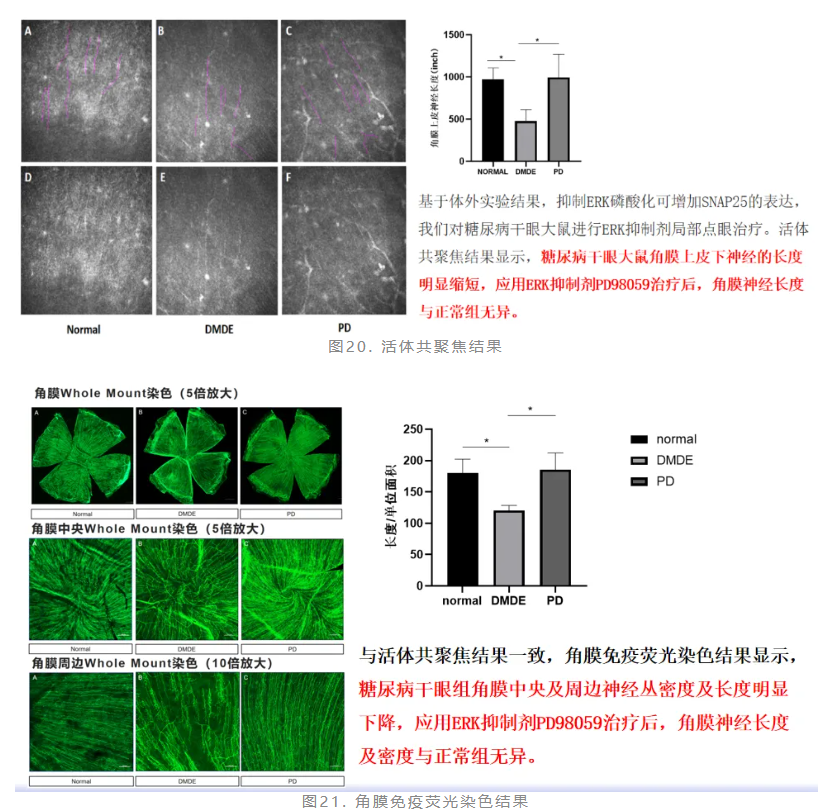
基于体外实验结果,抑制ERK磷酸化可增加SNAP25的表达,赵少贞教授团队对糖尿病干眼大鼠进行ERK抑制剂局部点眼治疗。活体共聚焦结果和角膜免疫荧光染色结果一致,均显示应用ERK抑制剂PD98059治疗后,角膜神经长度及密度与正常组无异(图20、图21)。
体内实验:P2X7与糖尿病相关干眼的神经损伤相关性研究
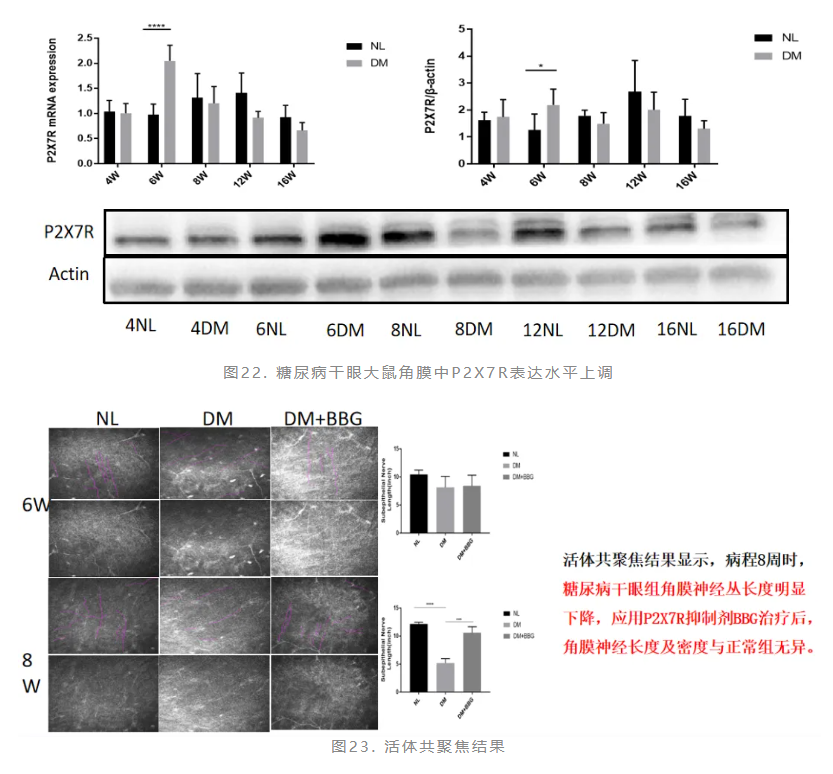
P2X7R是一种嘌呤能受体门控离子通道,在体内广泛分布,几乎存在于身体所有组织中,其主要功能有调节神经递质释放、参与胶质细胞与神经细胞间信号传递、参与突触传递及突触可塑性过程、炎性细胞因子释放的触发器等。P2X7R可在多种中枢(癫痫、AD、HD)及外周神经系统疾病(坐骨神经损伤等)中发挥作用。推测P2X7R有可能参与糖尿病疾病进展中角膜神经改变的过程,与糖尿病相关角膜损伤的发生发展有关。
研究结果显示,糖尿病干眼大鼠角膜中P2X7R表达水平上调(图22),抑制P2X7R的表达可修复糖尿病干眼大鼠神经损伤(图23、图24)。
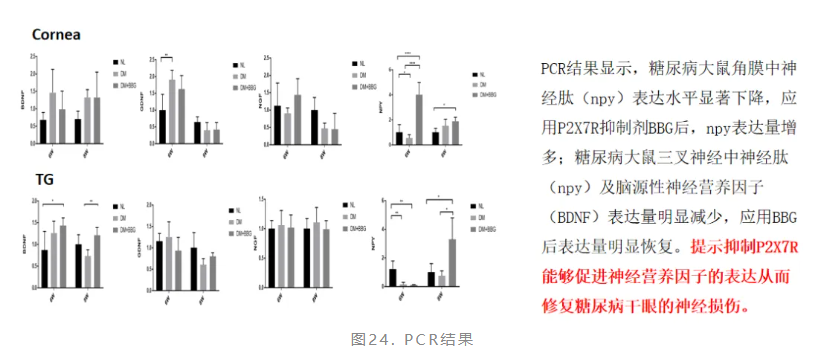
持续的高血糖可导致角膜神经损伤及糖尿病相关干眼的发生。PEDF、SNAP25和P2X7R与糖尿病相关干眼的神经损伤存在相关性,补充PEDF或其相关肽、SNAP25以及抑制P2X7R能够增加角膜神经密度,修复角膜神经损伤,促进泪液分泌,最终改善糖尿病相关干眼的眼表状况。赵少贞教授团队进行的一系列研究表明:角膜神经异常与糖尿病相关干眼密切相关,应重视糖尿病相关干眼患者角膜神经的异常改变,探索更多有效的神经生长因子逆转神经损伤,以期从根本上治疗干眼。
参考文献
1.中华医学会眼科学分会角膜病学组. 干眼临床诊疗专家共识(2013). 中华眼科杂志. 2013;49(1):73-75.
2.Tsubota K, Yokoi N, Shimazaki J, et al. New perspectives on dry eye definition and diagnosis: a consensus report by the Asia Dry Eye Society. Ocul Surf. 2017;15:65–76.
3.韦振宇, 刘含若, 梁庆丰. 我国干眼流行病学的研究进展[J]. 中华眼科医学杂志(电子版), 2020, 10(01): 46-50.
4.Ma R C W. Epidemiology of diabetes and diabetic complications in China[J]. Diabetologia, 2018, 61(6): 1249-1260.
5.郭建忠, 陈胜. 2 型糖尿病相关干眼发病机制的研究现[J]. 国际眼科杂志, 2018, 18(08): 1424-1426.
6.Stapleton F, Alves M, Bunya VY, Jalbert I, Lekhanont K, Malet F, Na KS, Schaumberg D, Uchino M, Vehof J, Viso E, Vitale S, Jones L. TFOS DEWS II Epidemiology Report. Ocul Surf. 2017 Jul;15(3):334-365.
7.Hossain P, Siffel C, Joseph C, Meunier J, Markowitz JT, Dana R. Patient-reported burden of dry eye disease in the UK: a cross-sectional web-based survey. BMJ Open. 2021 Mar 4;11(3):e039209.
8.Markoulli M, Flanagan J, Tummanapalli SS, Wu J, Willcox M. The impact of diabetes on corneal nerve morphology and ocular surface integrity. Ocul Surf. 2018 Jan;16(1):45-57.
9.Chen X, Graham J, Dabbah MA, Petropoulos IN, Ponirakis G, Asghar O, Alam U, Marshall A, Fadavi H, Ferdousi M, Azmi S, Tavakoli M, Efron N, Jeziorska M, Malik RA. Small nerve fiber quantification in the diagnosis of diabetic sensorimotor polyneuropathy: comparing corneal confocal microscopy with intraepidermal nerve fiber density. Diabetes Care. 2015 Jun;38(6):1138-44.
10.Itakura M, Kohda T, Kubo T, et al. Botulinum neurotoxin A subtype 2 reduces pathological behaviors more effectively than subtype 1 in a rat Parkinson’s disease model[J]. Biochemical and Biophysical Research Communications, 2014, 447(2):311-314.
11.Fleming T, Martinez-Moreno C G, Carranza M, et al. Growth hormone promotes synaptogenesis and protects neuroretinal dendrites against kainic acid (KA) induced damage[J]. General and Comparative Endocrinology, 2018: S0016648017307980.
12.Tombran-Tink J, Barnstable CJ. PEDF: a multifaceted neurotrophic factor. Nat Rev Neurosci. 2003 Aug;4(8):628-36.
声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。







 京公网安备 11010502033360号
京公网安备 11010502033360号
条评论
Linda Gareth
2015年3月6日, 下午2:51Donec ipsum diam, pretium maecenas mollis dapibus risus. Nullam tindun pulvinar at interdum eget, suscipit eget felis. Pellentesque est faucibus tincidunt risus id interdum primis orci cubilla gravida.